云南省药品监督管理局关于中药饮片生产品种备案有关问题的通知
云药监生〔2020〕20号
全省各中药饮片生产企业:
药品监管体制改革后,药品生产企业监管调整为省级药监部门事权,经研究,省药监局依法将原由各州、市药监局负责的中药饮片生产品种备案工作调整为由省药监局负责。为进一步规范备案工作,现将有关问题通知如下:
一、申请开办中药饮片生产企业的,在《药品生产许可证》申报资料中应该提供全部拟生产中药饮片品种目录;在申请药品GMP符合性检查前,企业应当完成所有拟生产中药饮片品种的工艺验证(净制、切制可按制法进行工艺验证),并完善相关验证资料在接受检查时提供。通过GMP符合性检查后,新增中药饮片品种生产的(除净制、切制中药饮片品种),应当按要求办理备案手续。
二、按照《云南省食品药品监督管理局关于实施新颁布中药饮片附录有关问题的通知》(云食药监药安〔2014〕59号)规定,在原各州、市食品药品监督管理局备案的执行法定标准的中药饮片品种继续有效,企业取得生产许可证后新增中药饮片品种未备案的、品种已备案但执行标准不符合法定要求的、执行标准已废止的或企业生产地址变更的,应当于2020年12月31日前重新办理备案手续。
三、2021年1月1日起,企业未办理备案手续的中药饮片品种不得生产和上市销售。
四、备案要求
(一)云南省药品监督管理局药化生产处负责备案的具体工作,负责接收备案资料并在对有关企业的日常管理工作中对备案资料合规性、真实性和完整性进行核实。
(二)中药饮片生产企业需要生产销售的所有品种应按要求办理备案手续,净制、切制按照制法进行备案,其余制法按照品种进行备案。新增制法的应当按要求申请GMP合规性检查。
(三)资料要求
1.纸质资料
(1)企业书面申请;
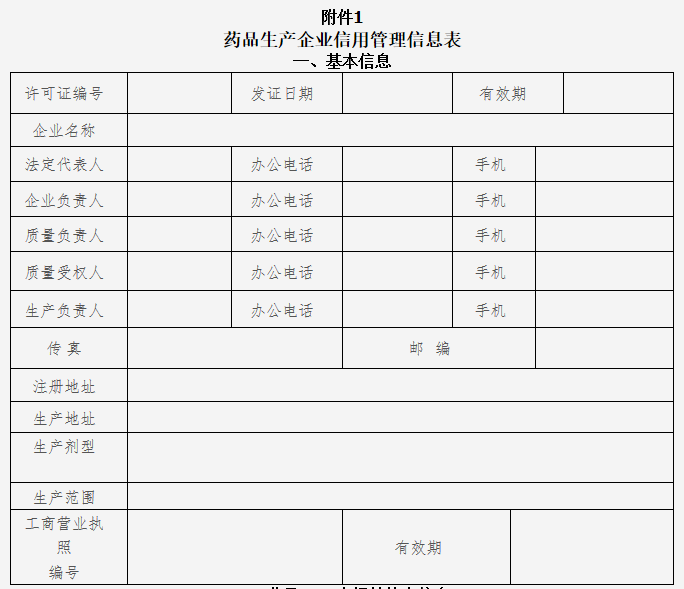
(2)《药品生产企业信用管理信息表》(附件1);
(3)企业《药品生产许可证》正副本复印件、《GMP证书》或通过GMP合规性检查证明文件复印件;
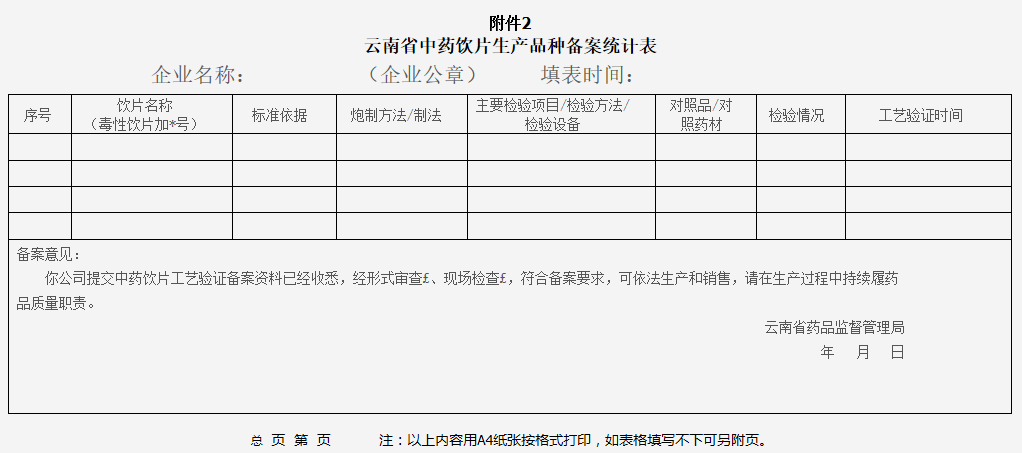
(4)中药饮片工艺验证备案统计表(附件2);
(5)申报材料真实性自我保证声明(附件3)。
2.电子版资料
(1)上述纸质材料扫描件;
(2)备案品种质量标准;
(3)备案品种生产工艺验证全套资料扫描件;
(4)主要生产设备列表;
(5)检验用主要仪器设备列表;
(6)《药品生产企业信用管理信息表》(附件1)
(7)企业备案品种统计表(附件2)电子版。
附件:
1.药品生产企业信用管理信息表
2.中药饮片工艺验证备案统计表
3.申报材料真实性自我保证声明
云南省药品监督管理局
2020年6月16日
联系人及电话:杨长春,0871-68571962
邮箱:32567395@qq.com
(此件公开发布)

附件3
云南省中药饮片生产品种备案
申报材料真实性自我保证声明
云南省药品监督管理局:
我单位申请 。
我单位保证提交的资料内容真实、有效,并对申请资料实质内容的真实性负责。
法定代表人签字: 企业公章
年 月 日 年 月 日