人心脏不具有成体干细胞已成为学术界共识。胚胎发育中出现的心血管祖细胞(cardiovascular progenitor cells, CPCs)是体内唯一公认的具有心肌分化能力的干细胞,并具备血管平滑肌细胞和血管内皮细胞分化潜能,具有广阔的心脏再生应用前景。在移植至梗死心脏后,CPCs不仅可补充受损的心肌细胞,还可以通过分化为毛细血管改善梗死区血液循环,促进内源和外源心肌细胞存活。多项研究证明,移植CPCs可以明显提升心梗后心功能,并展现出比单纯心肌细胞移植更显著持久的效果。因此,CPCs作为目前最有希望的心脏替代疗法供体细胞之一,展现出了广阔的临床应用前景。然而,CPCs仅在胚胎发育过程中存在,如何从成年人获取和扩增CPCs细胞成为亟待解决的关键问题。
中山大学中山医学院曹楠教授团队在生物医学工程领域著名期刊Nature Biomedical Engineering期刊(中科院1区TOP,IF="23.7)上发表了题为“Reprogramming" of fibroblasts into expandable cardiovascular progenitor cells via small molecules in xeno-free conditions”的论文。该研究首次使用小分子化合物组合将小鼠和人成纤维细胞重编程为CPCs(化学诱导的心血管祖细胞,chemically induced CPCs, ciCPCs)并实现其规模化扩增。将ciCPCs移植至梗死心脏后,其可同时促进瘢痕区心肌重建和血管化,进而显著促进梗死心脏修复和心功能恢复。从而创建了从病人自体细胞制备和扩增CPCs,进而用于心脏修复的新策略。
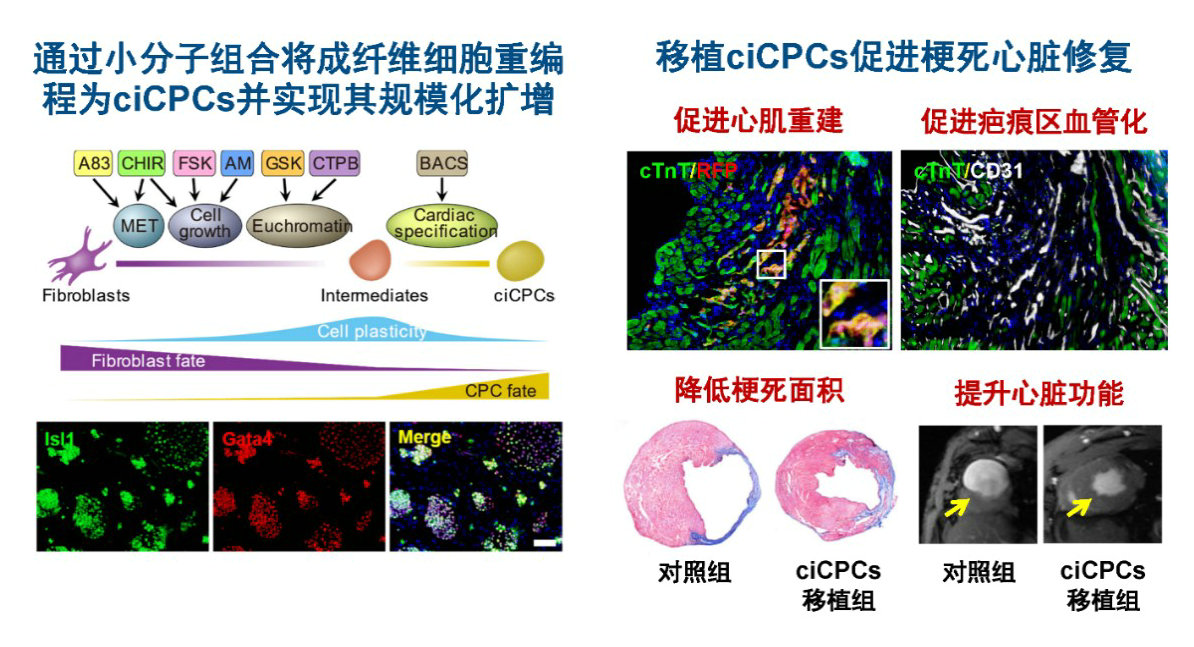
图注:通过体细胞重编程获得的心血管祖细胞治疗心肌梗死
中山医学院特聘副研究员王嘉博士及顾珊珊博士为论文的共同第一作者。曹楠教授为论文的通讯作者。该研究受到国家重点研发计划、国家自然科学基金、及广东省“珠江人才计划”引进创新创业团队等项目的支持。



