血吸虫病是由血吸虫感染引起的人兽共患寄生虫病,是仅次于疟疾的全球第二大寄生虫病。据统计,全球约有2.4亿血吸虫病患者,每年有25万人死于血吸虫病。我国还未消除血吸虫病危害且还受到输入性血吸虫病的威胁。“宿主—血吸虫之间的相互作用”一直是血吸虫病防治研究的重要科学问题和研究前沿。
近日,中山大学中山医学院吴忠道教授团队在Molecular Therapy(IF=11.454,中科院一区)杂志上发表了题为“Host Liver-Derived Extracellular Vesicles Deliver miR-142a-3p Induces Neutrophil Extracellular Traps via Targeting WASL to Block the Development of Schistosoma japonicum”的研究成果。
该研究采用小鼠模型,从宿主细胞外囊泡的角度,发现日本血吸虫感染后,小鼠肝组织来源的胞外囊泡可以通过传递重要宿主源性miRNA(miR-142a-3p)特异性靶向WASL(编码Wiskott-Aldrich综合征蛋白的基因)诱导中性粒细胞外捕获网(NETs)形成,从而抑制血吸虫的生长发育。同时,NETs可以上调趋化因子CCL2募集巨噬细胞杀伤血吸虫。特别值得关注的是,血吸虫可以通过上调IL-10来抑制NETs形成,从而达到免疫逃逸的目的。该研究从宿主细胞外囊泡角度全新阐述了宿主-血吸虫相互博弈的分子机制,也为血吸虫病和相关感染性疾病的防治提供了新的思路。
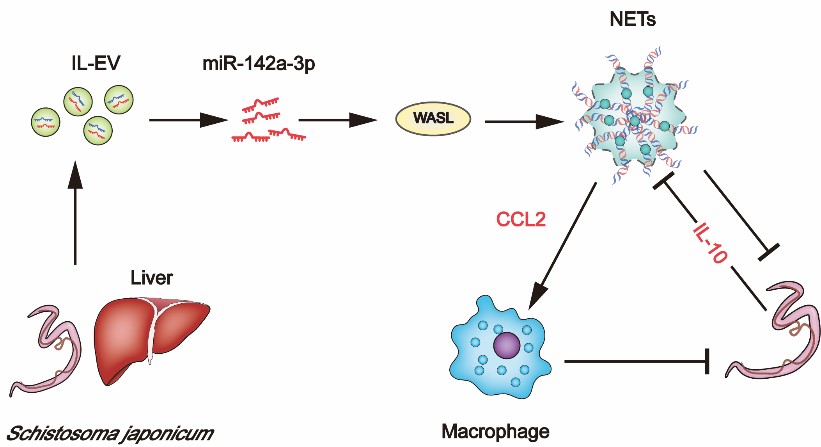
图注:小鼠肝组织来源的胞外囊泡宿主源性miRNA(miR-142a-3p)特异性靶向WASL诱导中性粒细胞外捕获网(NETs)形成抑制血吸虫的生长发育模式图
此研究是该团队近期胞外囊泡研究工作的进一步延伸。此前,该团队从血吸虫细胞外囊泡出发,在国际细胞外囊泡协会会刊Journal of Extracellular Vesicles发表了题为“Sja-miR-71a in Schistosome egg-derived extracellular vesicles suppresses liver fibrosis caused by schistosomiasis via targeting semaphorin 4D”的研究论文,揭示了血吸虫虫卵细胞外囊泡对宿主的跨物种调控功能。结合这两项研究成果,提示在宿主—血吸虫相互作用的过程中,不仅血吸虫可以通过虫源性细胞外囊泡对宿主进行跨物种调控,达到逃逸宿主攻击的目的;宿主亦可以通过自身细胞外囊泡抑制血吸虫,缓解血吸虫对自身的病理损伤,对于我们理解寄生虫与宿主之间复杂的相互作用关系提供了新的线索,值得我们在未来的研究中对其进行进一步的关注。
中山大学中山医学院孙希副教授和吴忠道教授为本论文共同通讯作者,广州医科大学王立富教授和中山大学中山医学院朱梓锋博士为论文共同第一作者。此研究受到国家重点研发项目、国家自然科学基金等基金支持。



